研究・サイエンス
Research & Science
エクソソーム
エクソソームとは、線維芽細胞、内皮細胞、血球細胞などをはじめ、がん細胞などの異常細胞からも分泌される生命維持に重要な役割を担う脂質二重膜構造を有した細胞外小胞(100ナノメートル程度の粒子)になります。
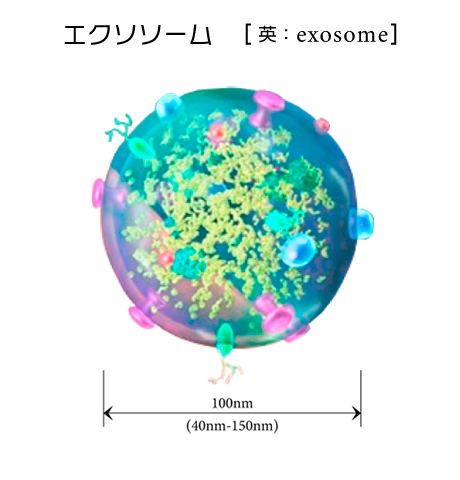
発見当初(1983年)エクソソームは、細胞内の老廃物を細胞外に放出する “ただのゴミ袋のようなもの” としか考えられていませんでした。
しかし、2007年のエクソソームにmiRNA(マイクロRNA) が含まれているという研究報告を契機に、ここ10年で研究が目覚ましく進歩したことで、今では “全ての疾患治療の根本を変える” とまで言われるようになり、今、世界中の研究者が最も注目する研究対象になっています。
実際、エクソソームの役割が次々と解明されると、がんをはじめ、アルツハイマー病、神経変性疾患、糖尿病などの生活習慣病を含む、様々な疾患の発症・増悪機序に影響していることが分かり、エクソソームの価値は、現在、診断や治療への応用へと拡がりはじめています。
細胞・臓器間のコミュニケーション
これまで医学の常識では、人体において脳が司令塔となり他の臓器はすべてそれに従っていると考えられてきました。
しかし、エクソソーム研究によって、人体に対する考え方の根本を見直す必要が出てきました。
善玉エクソソームと悪玉エクソソーム
カラダが正常に機能し、健康な状態を保つには、実は細胞同士がエクソソームを介して直接コミュニケーションを取り合い(善玉エクソソーム)、それぞれの臓器を適切に動かしていることが、エクソソーム研究によって明らかにされたのです。
また一方では、がん細胞の転移において、エクソソームが悪用(悪玉エクソソーム)されていることも解明されました。
がん転移のメカニズム
がん細胞転移では長年にわたり「がん転移最大の謎」と言われてきた現象がありました。
それは、がん細胞が転移する前に転移先の組織において、線維芽細胞・血管・リンパ管などが変化し、がん細胞を受け入れるためのお膳立てがされるという現象です。実は、この現象にエクソソームが関与していることが分かりました。
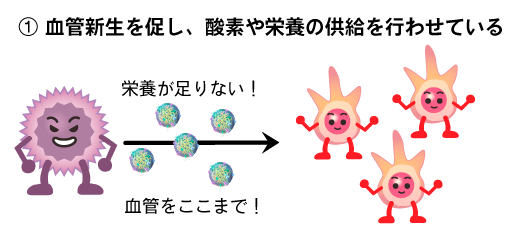
①がん細胞は、組織が大きくなると中心部に血管が届きにくくなるので、まず血管を周囲から引き込むためエクソソーム(悪玉エクソソーム)を利用します。
この血管新生はがん組織が必ず見せる振る舞いの一つになります。

②血管新生後、原発巣から剥離したがん細胞は、引き込んだ毛細血管から大血管に入り込み、他の臓器に移動します。
この時、がん細胞はエクソソームを使い、免疫細胞に自分は敵ではないというメッセージを送ることで、免疫機能をかいくぐります。
つまり、がん細胞は、まず転移先の組織にもエクソソームを放出し、あらかじめ、がん細胞が定着しやすい環境をつくり、後からやってくるがん細胞を誘導して、やすやすと新たな活動拠点を手に入れていたのです。
このエクソソームを悪用したがん細胞の転移メカニズムの発見は、今後のがん研究において、とても大きなブレイクスルーになることが期待されています。
落谷教授の研究プロジェクト

世界が注目するエクソソーム研究で最先端を走り、世界をリードする落谷教授は、現在、東京医科大学 医学総合研究所 分子細胞治療研究部門において、がんをはじめ、様々な疾患に対する新しい診断法や治療法の確立を目指しています。
核酸医薬、生体イメージング、ステム細胞、再生医療、細胞工学、分子腫瘍学などの領域で蓄積してきた経験を基礎に、常に新しい分野の開拓にチャレンジすることで、核酸医薬を医師主導治験にまで推し進め、これまでもマイクロRNAの前臨床試験や体液診断の実用化開発を発展させてきました。
実際、がん細胞が分泌するエクソソームに内包されたマイクロRNAによるがんの転移メカニズムの解明は、従来の「がん診断」とは別次元の高い水準の感度と特異度を持ち、超早期発見が可能な「がん診断」を生み出しました。
さらにがん以外の様々な疾患でもエクソソームの役割が解明されているので、エクソソームを標的とした新規治療法の開発は、最新の研究分野として世界中から注目されています。
テロメア
テロメアの役割
テロメアとは、私たちの設計図である遺伝子(遺伝情報)を保護するため、DNA末端に形成された「(5’-TTAGGG-3’)n 」特徴的な繰り返し配列のことです。
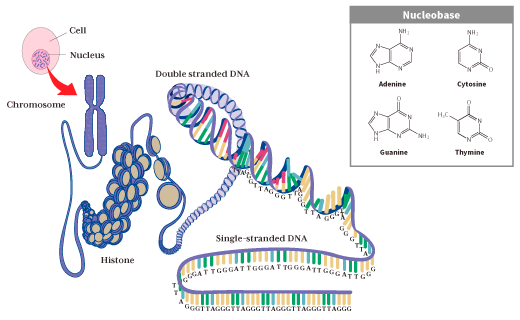
私たちヒトは、たった1つの受精卵がもつ遺伝情報に基づいて、分裂・分化を繰り返して構成された生命体になります。すべての細胞(37.2兆個)には、受精卵から継承された遺伝子が、染色体を構成しているDNAに刻まれており、細胞核に収められています。
私たちヒトは生命を維持するため、日々、細胞分裂を繰り返しますが、細胞分裂時の複製工程でどうしてもDNAの末端(テロメア)が、20~200塩基対ずつ短くなってしまいます。(末端複製問題)
そのため、遺伝情報を損なわないようテロメアが限界まで短くなる(分裂限界)と、科学的シグナルを送り、細胞は不可逆的に分裂を停止(細胞老化)して、重要な遺伝情報を保護しているのです。
加速するテロメア短縮
テロメア短小化は、加齢関連疾患の事実上寄与因子だと考えられています。個人のテロメア長を決定する要因には遺伝と環境要因がありますが、実際のところ、個人のライフスタイルによる環境要因が大きく影響しています。
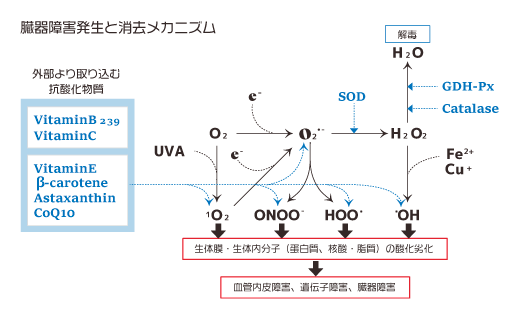
肥満、喫煙、運動不足、精神的ストレスなど、いわゆる不健康なライフスタイルを送るとフリーラジカルの生成や炎症を引き起こすため、テロメアは加速して短縮することになるのです。
環境因子(環境化学物質、UVAなど)や炎症により、酸化反応と抗酸化反応のバランスが崩れた酸化ストレス状態では、過剰生成された活性酸素種や過酸化物によって、テロメアのG連続配列が著しく損傷することが近年の研究で明らかにされています。
ヒト細胞のテロメア長を「末端複製問題」から計算すると、ヒトの理論的な最高年齢は125歳だと考えられています。歴史的にも120 歳を超えて生きた人は1 人しかいません。つまり、どんなに健康的な食事を摂っても、どれだけ運動しても基本レベルのテロメア短縮を止めることは出来ません。
それは、長寿世界一の日本でも男女合わせた平均寿命は83.7 歳であることからも分かるように、誰もが最高年齢まで生きるのではなく、人それぞれでのライフスタイルによって、テロメア短小化のスピードは異なってくるからです。
テロメア短縮と健康
基本レベルの短縮化であれ、加速された短縮化であれ、テロメア長が極端に短くなると、私たちの健康状態は、崖から落ちるように急激に悪化し、複数の加齢関連疾患を患うようになります。
例えば、褥瘡(じょくそう)という症例で説明すると、褥瘡は老化が原因のように思われていますが、これは同じ体勢で寝ている時に皮膚とシーツの摩擦によって発生する症状です。本来、褥瘡のようにダメージを受けた細胞があっても、代わりになるべくして他の細胞が分裂するので褥瘡は治癒します。しかし、寝たきりだと、治っては発生して、発生しては治すというサイクルが繰り返され、褥瘡周辺の細胞のテロメアが極端に短くなり、代わりになるべく細胞の分裂が行われないため、褥瘡は治らなくなってしまうのです。さらに、褥瘡が治らず常に傷がある状態であれば、感染しやすいので命に危険が及ぶことにもなりかねないというわけです。
ビル博士の発見

世の中には、老化の兆候を示さない生き物は割と多く存在しています。老化の兆候を示さない一例をロブスターで簡単に説明すると、ロブスターの細胞内では、テロメアの特異的反復配列を伸長させる" テロメラーゼ" という酵素が産出されていることが分かっています。この酵素の機能は1つだけ、テロメアが短くなると染色体の端に塩基を足す事になります。
つまり、テロメラーゼが発現する細胞を持つ生き物は、テロメア時計がひとつ時を刻むと、テロメラーゼが時計の針を元に戻してくれるので、寿命のカウントダウンは進まない、老化の兆候を示さないという事になります。
残念ながら私たちヒトは、骨、筋肉、内臓、脳といった身体を構成する細胞のテロメラーゼ発現遺伝子が不活性状態にあり、テロメラーゼが発現されていません。しかし、細胞約270 種類の中で、3種(生殖細胞・ガン細胞・幹細胞)だけはテロメラーゼを発現していることがわかっています。
当初、これら3種がヒト細胞において特殊な仕組みを持つ、特異な細胞と思われていましたが、1つの細胞から分化してできた270 種の細胞であれば、全て同じ仕組みを持っているはずだと考えた研究者がいました。
それが“時間を止める男” としても知られるビル・アンドリュース博士です。
❖ その1 テロメラーゼを発現しない理由の解明― [Patent Number: US5583016, Issued 1996-12-10] ―
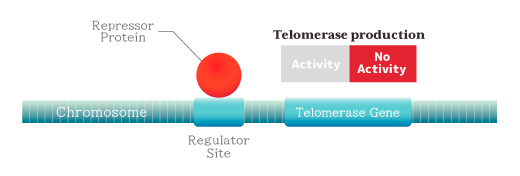
テロメラーゼ発現遺伝子に隣接するDNA(Regulator site)にタンパク質(Repressor)が結合されることで、テロメラーゼ発現遺伝子は不活性状態になり、テロメラーゼの発現は抑制される。
❖ その2 テロメラーゼ誘導活性化物質― [Patent Number: US7199234, Issued 2007-04-03] ―
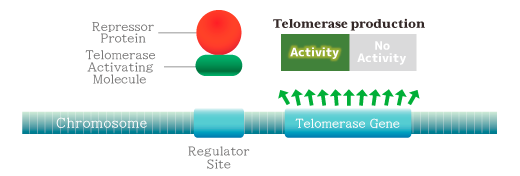
TAMによりレギュレータにリプレッサーが結合することを制御することで、テロメラーゼ発現遺伝子のスイッチをONにでき、テロメラーゼの発現を誘導することが可能となる。
細胞活性化
私たちの臓器や組織は、幹細胞システムによる絶え間のない再生機転によって生涯にわたり維持されています。
しかし、様々な抗老化システムを持つ幹細胞も加齢に伴い「老化する」(ステムセルエイジング)ため、臓器の加齢変化や加齢関連疾患をもたらしていることが認識されつつあります。
加齢に伴い幹細胞は、自己複製能が低下し、分化異常・細胞死の亢進などを引き起こし、幹細胞が枯渇・劣化していくことが臓器機能の低下へとつながり、幹細胞における遺伝子変異の蓄積が、がん化などの疾患発症リスクを高めています。
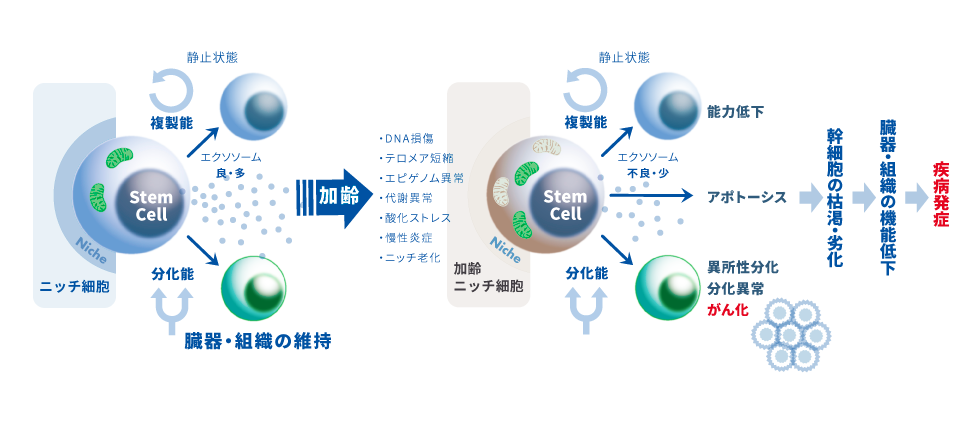
ExoEarthでは、先述したテロメアやエクソソームの研究に基づき、加齢に伴って低下していく生理機能を活性させるための『細胞活性化メソッド』を確立しました。
具体的には、最先端生命科学に基づく「解析技術」や「診断方法」を用い、個人(細胞)毎の健康状態を把握しながら、個々人(細胞)の健康状態に合わせた「最先端治療」や「独自開発したヘルスケア商品」によって、私たち(細胞)が本来持つ生理機能を正常化させていくメソッドになります。

